비전공자가 작성한 내용으로 정확하지 않을 수 있습니다. 참고만 하세요
RNAi (RNA interference)
DNA에서 RNA 중합효소가 (RNA Polymerase)가 mRNA를 생성하고, 이 mRNA를 해석해 리보솜이 펩타이드를 결합해 단백질을 만들어내는 과정이 Central Dogma. RNA 치료제는 이러한 Central Dogma에 개입해 이용해 질병을 치료한다.
RNA치료제는 RNA interference 라는 과정을 이용한다. RNAi는 세포 내에 존재하는 자연적인 과정으로, 단백질을 만드는 mRNA와 반대되는 RNA 사슬인 miRNA, siRNA를 통해 mRNA를 분해해 유전자 표현을 억제하는 과정이다. 이 RNAi는 유전자 발현 뿐만 아니라 바이러스를 상대하는 선천적 면역시스템의 역할도 가지고 있다.
miRNA: micro RNA
miRNA는 아래와 같은 단계를 통해 체내에서 생산되어 mRNA 번역 과정을 저해한다.
miRNA는 (1) DNA에서 전사되어 Pri-miRNA형태로 꼬이고 이것이 (2) DROSHA라는 단백질에 의해 Pre-miRNA로 절단된다 (3) 이후 Exportin 5에 의해 체외로 전송되며 Dicer 단백질에 의해 절단된다. (4) 결과물로 생성된 miRNA Duplex는 Argonaute(아르고노트) 단백질에 결합해 Unwind되고, 다른 단백질과 결합하여 RISC를 형성한다. (RNA Induced Silencing Complex)
이렇게 형성된 RISC는 mRNA에 결합해 RISC가 mRNA를 절단해 무력화하거나, RISC가 결합하는 것으로 mRNA의 번역 과정이 막히며 역할을 무력화한다.
자세한 과정은 아래 동영상으로도 확인할 수 있다.
siRNA: small interfering RNA
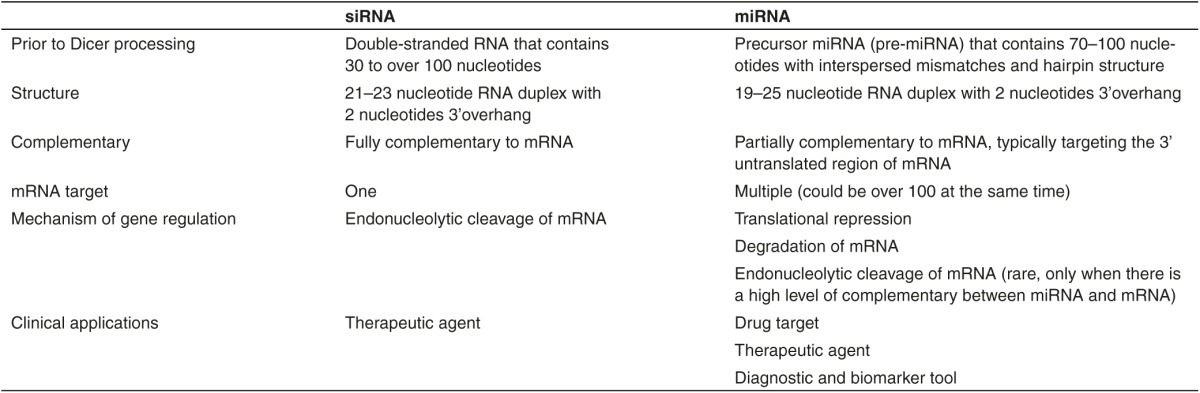
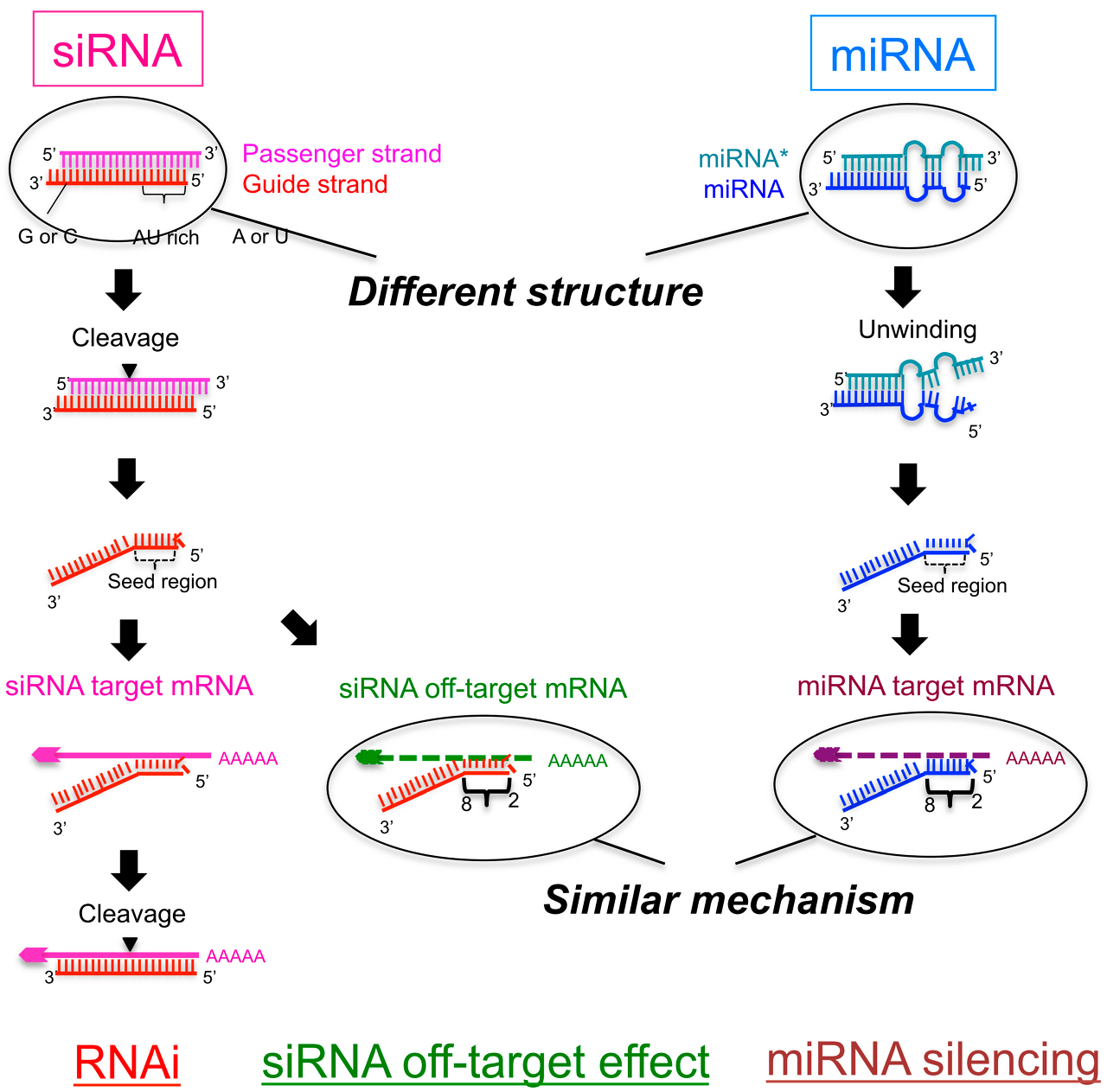
siRNA는 miRNA는 둘다 길이는 비슷하고, Argonaute 단백질 및 다른 단백질과 RISC를 형성하여 mRNA를 절단하거나 단백질 생산과정을 방해한다는 공통점을 가지고 있다. 그러나 둘은 몇 가지 다른 특징을 가지고 있다.
siRNA는 miRNA처럼 유전자 내에 별도로 Encoding 되어 있는 것이 아니고, 다양한 방법으로 세포 내에 존재하는 dsRNA로부터 생성된다. (1) 체내에서 Hairpin structure를 형성할 수 있는 RNA가 자체적으로 꼬이거나 (2) 동일 유전자가 각각 반대로 전사되며 Sense / Antisense RNA가 형성되어 결합하는 경우 (3) 바이러스 감염으로 바이러스의 dsRNA가 세포에 투입되는 경우 (4) 실험용으로 체내에 투입되는 경우이다.
이렇게 세포질 내의 dsRNA는 Dicer 단백질에 의해 21~23bp 길이의 siRNA로 잘린다. 이후 miRNA가 RISC를 형성하는 과정과 유사하게 Argonaute 단백질과 결합하며 RISC를 형성하고, 일치하는 염기서열의 mRNA를 자르거나 침묵시킨다.
그 외 다른 특징으로는 Specificity가 있다. siRNA는 mRNA와 완벽히 상보적인 서열로 결합한다. 이에 좀 더 높은 정확도를 가지고 있다. 그러나 miRNA는 Seed라고 부르는 일부분이 일치하는 경우 RISC가 mRNA에 결합하기 때문에, 하나의 miRNA가 다양한 mRNA를 무력화 시킬 수 있다.
물론 siRNA에도 miRNA와 같이 Off target effect가 발생할 수 있다. RNA는 완전히 상보적인 서열이 아니라도 서로 결합할 수 있기 때문이다.
이러한 RNAi 과정은 바이러스를 상대하는 몸의 선천적 면역이기도 하다. 바이러스가 주입한 dsRNA가 Dicer에 의해 잘리며 siRNA를 형성하고, 이것이 RISC를 형성하면 상보적인 염기서열을 가진 바이러스의 mRNA에 결합해 이를 잘라버리거나 무력화 시키게 되며 바이러스 단백질의 합성을 막는다.
RNAi 치료제의 전달
다른 약품과 마찬가지로 RNAi 치료제 또한 목표 위치까지 이를 전달하는 것이 매우 어렵다. (1) 혈청 단백질의 응집 (2) 효소에 의한 분해 (3) 신장의 여과 (4) 세포막과 모세혈관 내피장벽 통과 등 다양한 장벽이 있어 RNAi 치료제를 원하는 위치까지 전달하기 어렵다.
이에 대응하기 위해 제약사들은 RNA의 백본(Backbone을) 변형해서 효소분해 저항성을 높이거나, LNP 및 GalNAc 등 전달체를 사용해 표적까지 전달하는 방식을 사용하고 있다.
RNAi 치료제 예시 (1) : Onpattro / Patisiran
Alnylam에서 개발한 약품이며, siRNA 치료제이다. hATTR 아밀로이드증의 치료제로 승인되었다.
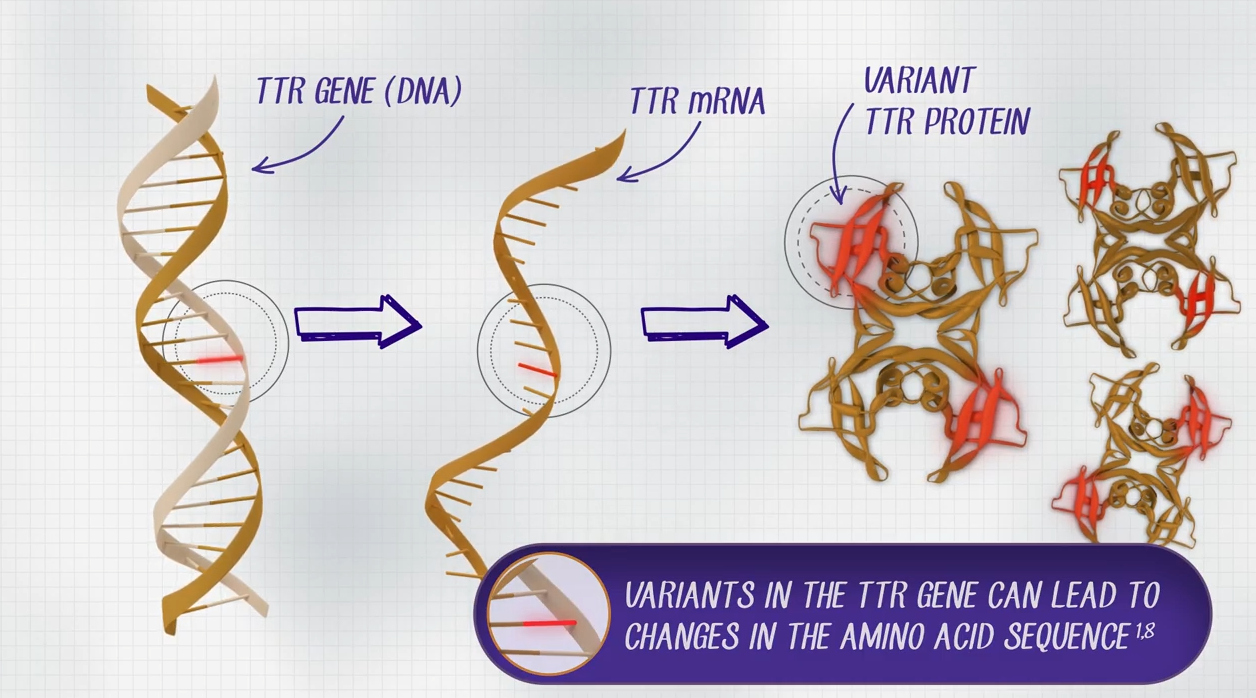
hATTR 아밀로이드증은 (hereditary ATTR amyloidosis) 간에서 생성되는 TTR(Transthyrtin) 단백질 유전자의 변형으로, 비정상적인 단백질이 생성 및 응집되어 생기는 병이다. 비정상적인 TTR 아밀로이드는 서로 응집하여 말초신경, 심장, 신장 등에 축적되며 다양한 문제를 일으킨다. 전 세계 약 5만명 정도 앓고 있는 희귀병이다.
Onpattro는 LNP에 siRNA를 포장해 이를 간세포로 보낸다. 이 siRNA는 LNP를 타고 세포 내로 흡수되어 변형된 TTR 단백질을 만들지 못하도록 문제 mRNA를 침묵시킨다.
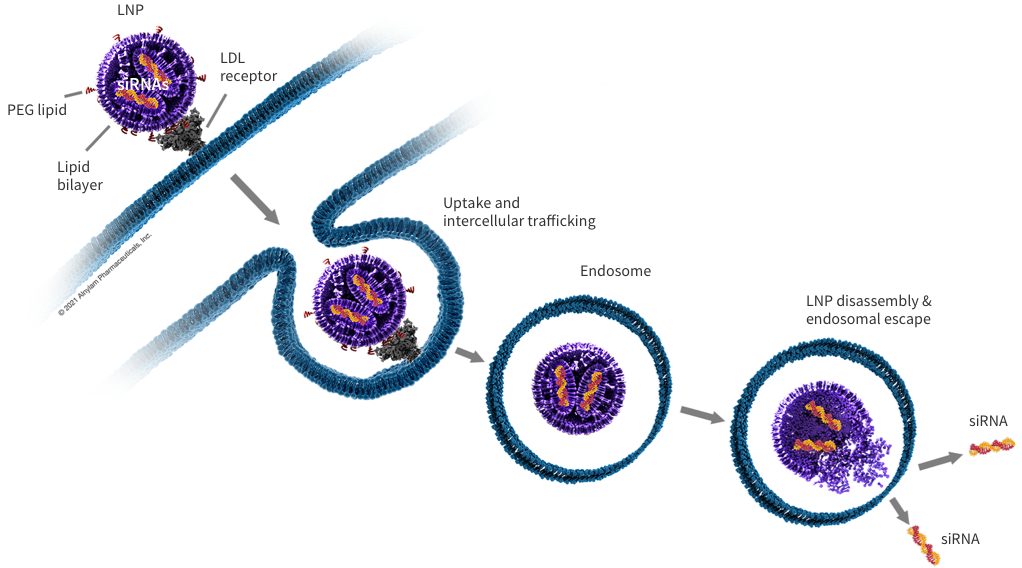
RNAi 치료제 예시 (2): Inclisiran / Leqvio
Alnylam에서 개발한 약품이며, siRNA 치료제이다. 고지혈증 치료제로 승인되었다.
Inclisiran은 혈중 LDL콜레스테롤을 줄이는 것이 목표인데, PCSK9이라는 단백질을 무력화 하는 것으로 목표를 달성한다. PCSK9 단백질은 간에서 분비되어 LDL 수용체에 결합하고 간 세포 내에서 분해시키는데, 간세포의 LDL 수용체가 감소하니 혈중 콜레스테롤 농도가 상승한다.
Inclisiran은 siRNA로 PCSK9 단백질의 생산을 줄인다. PCSK9 단백질을 만드는 mRNA를 인식할 수 있는 siRNA를 주사해 이 단백질이 RISC에 결합하고, RISC는 해당 mRNA를 무력화한다 해당 유전자가 세포 내로 잘 전달될 수 있도록 siRNA에 GalNAc이라는 을 부착한다.
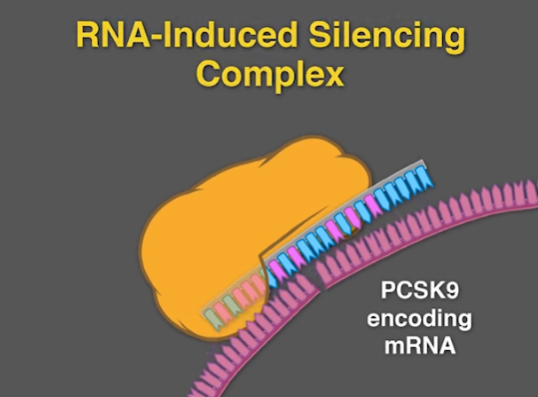
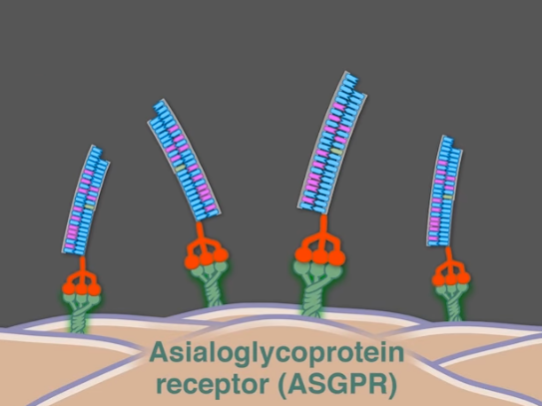
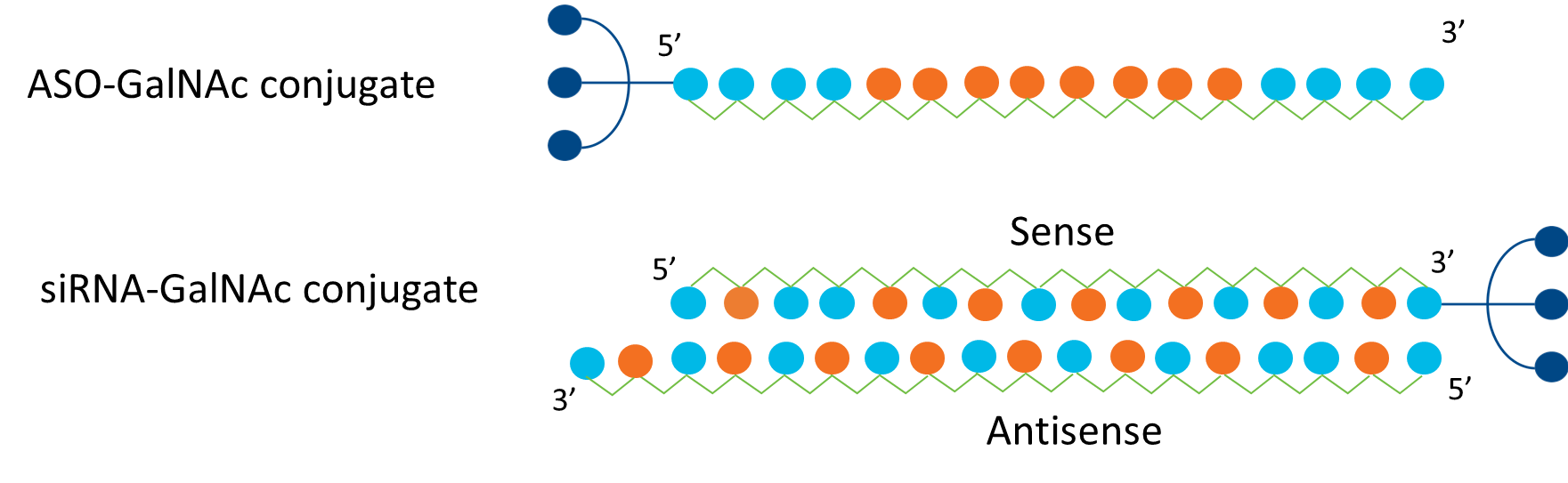
간세포의 표면에는 ASGPR이라는 당단백질 수용체가 다수 있는데, 이 수용체는 혈중 당단백질과 결합하여 혈중 당단백질의 농도를 조절한다. 다른 세포에는 수용체의 표현이 제한적이다. Inclisiran은 이 수용체에 매우 높은 Affinity로 결합하는 GalNAc의 삼량체(Trimer)를 siRNA에 부착해 간세포에 전달한다.
'산업 공부 > 바이오' 카테고리의 다른 글
| 치매의 과거 치료와 Lecanemab 임상 발표 (0) | 2022.10.03 |
|---|---|
| 유전자치료 벡터의 종류 (0) | 2022.08.09 |
| DNA이중가닥 절단의 수리 (0) | 2022.08.08 |
| ASO 치료제와 Antisense RNA (0) | 2022.08.03 |
| non-coding RNA의 종류 (siRNA, miRNA, snoRNA, snRNA) (0) | 2022.08.01 |
| 바이오 산업 관련 용어 정리 (0) | 2022.07.18 |
| 당뇨병과 글루카곤 저항성 (0) | 2022.07.15 |
| 항암 표지인자 (TROP-2, KRAS, HER-3) (0) | 2022.07.13 |